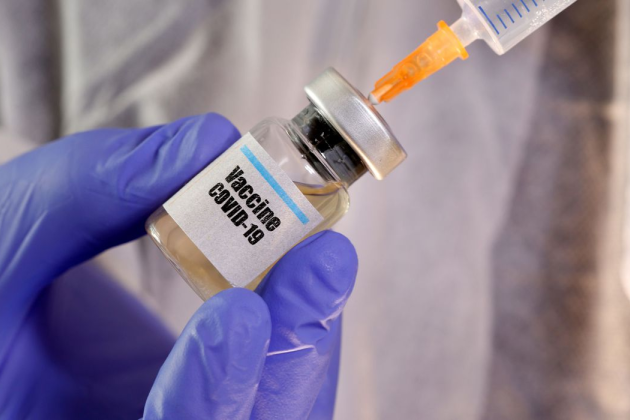
A solicitação foi feita pelo Butantan há semanas e autorizada, agora, “em caráter excepcional”, diz a Anvisa, “para fabricação da vacina adsorvida Covid-19 (inativa), em estudo clínico fase III, ainda sem registro no Brasil. Os estudos ainda estão em andamento e não existe previsão de data para a vacinação.”, completa a nota.
Segundo a Agência, o tema foi debatido em um conselho deliberativo entre ontem e hoje. A decisão levou em conta a certeza dada pelo Butantan que o imunizante só seria distribuído à população se houver o “deferimento do registro da vacina pela Anvisa” e o acompanhamento póstumo do fármaco na população. No voto do relator, que foi acompanhado pelos demais diretores da Anvisa, há a ponderação de que a fábrica onde a Sinovac produz as vacinas ainda não possui avaliação de órgãos internacionais especializados. No entanto, no último dia 22, a farmacêutica enviou à Anvisa os documentos de inspeção realizados pelas autoridades chinesas.
A Anvisa também determina que o Butantan é inteiramente responsável pelo transporte responsável das 120 bolsas com 200 litros cada “contendo formulado em granel de VACINA adsorvida COVID19 (inativa)”.
“O Instituto Butantan ficará inteiramente responsável por garantir a adequabilidade do transporte, armazenamento e guarda do produto, se responsabilizando pelas instalações, equipamentos, pessoal, medidas e procedimentos necessários para a contenção, ou seja, para a segurança do meio ambiente e do operador, bem como a integridade dos recipientes usados para armazenar produtos intermediários.”, diz trecho do voto do relator.
Leia a nota completa abaixo:
Anvisa autoriza importação de matéria-prima para vacina
Anvisa autorizou nesta quarta-feira (28/10), a importação em caráter excepcional da vacina na forma de um produto intermediário, isto é, produto não envasado, fabricada pela empresa Sinovac Life Sciences Co. LTD.
A solicitação foi feita pelo Instituto Butantã para importação, em caráter excepcional, da matéria-prima para fabricação da vacina adsorvida Covid-19 (inativa), em estudo clínico fase III, ainda sem registro no Brasil. Os estudos ainda estão em andamento e não existe previsão de data para a vacinação.
O tema foi discutido em Circuito Deliberativo, entre esta terça-feira (27/10) e quarta-feira (28/10). O Circuito Deliberativo é uma instância de votação on-line dos diretores da Agência.
A autorização definiu algumas condições para a importação excepcional. A decisão e o teor do voto estão disponíveis aqui. Não há ainda vacinas autorizadas no Brasil, acompanhe a situação dos estudos em andamento.
Com Informações: Carta Capital/Foto: Agência Brasil
Posts relacionados
Rede Clima TV




 O único Grupo de Comunicação da região que agrega imprensa radiodifundida e televisão, nos formatos atuais da nova sociedade.
O único Grupo de Comunicação da região que agrega imprensa radiodifundida e televisão, nos formatos atuais da nova sociedade.